がんゲノム医療について
【執筆】 四十物 絵理子(慶應義塾大学医学部腫瘍センターゲノム医療ユニット) 【監修】西原 広史(慶應義塾大学医学部臨床研究推進センター兼腫瘍センターゲノム医療ユニット)(令和3年3月)
目次
- 【はじめに】
- 1.がんゲノム医療の基礎知識
- 2.がんゲノム医療における遺伝子検査
- 3.がん遺伝子パネル検査とコンパニオン診断薬(CDx)との違い
- 4.がんゲノム医療の治療における問題と課題
- 【終わりに】
【はじめに】
今、日本人の半数が亡くなるまでに何らかのがんの診断を受けています。こういう時代であるからこそ、がんに対する正しい知識を深めることが大切だと思います。近年のDNAや遺伝子研究の進歩によって、がんの発生について新しいことがたくさんわかり、ゲノムレベルで治療を考える時代となりました。ここでは、ゲノムとがんとの関わりをみていきましょう。
1.がんゲノム医療の基礎知識
1(1)遺伝子について
私たちの体はさまざまな臓器から作られています。臓器は体の中で、それぞれ大事な役割を担っています。例えば心臓は絶えず全身に血液を送り込むポンプのような役割を担い、脳は神経を使って筋肉などに命令を出す司令塔のような役割をしています。すべての臓器は小さな細胞から構成されています。そしてすべての細胞の中には同じDNAと呼ばれる二重らせん状の構造物が入っています。DNAはアデニン(A)・チミン(T)・グアニン(G)・シトシン(C)と呼ばれる4つの塩基によって描かれた非常に長い「個体の設計図」と考えてください(図1)。これまで人類はDNAという壮大な設計図の解明に必死で取り組んできました。アメリカでは30億ドルという多額の予算が組まれて研究が進み、2003年にヒトDNAの全塩基配列が解明されました(ヒトゲノム計画)。しかし、塩基配列は明らかになったものの、その配列がどのような意味をもつのか、大変難しい課題が残りました。その後さまざまな研究が重ねられ、特定の塩基の配列がどのような意味を有しているのか、徐々にわかってきました。その意味付けされた塩基配列領域は「遺伝子」と呼ばれています(図2)。わかっている遺伝子の数は約2万2000個といわれています。しかし、現在においてもその遺伝子といわれる領域の全塩基を合計してもすべてのDNAの中の約1.5パーセント程度にすぎず、さらにその中には解釈がはっきりしていない領域も含まれています。つまり、実はほとんどのDNA配列はいまだ役割が不明なのです。
DNAの構造について少し説明します。ヒトDNAは図1のような二重らせん構造をしており、約30億個の塩基対(A-T, C-G)は、引き伸ばすと約2メートルに及びます。その長い二重らせんはヒストンというものに巻き付いてコンパクトに折りたたまれ、それが密集して図2の洗濯ばさみのような染色体という構造物をつくり、細胞の核のなかに入れられています。染色体は母親由来のもの(23本)と父親由来のもの(23本)があり、合計46本が細胞の核の中に入っています。

図1.ATGCで書かれた二重らせん構造
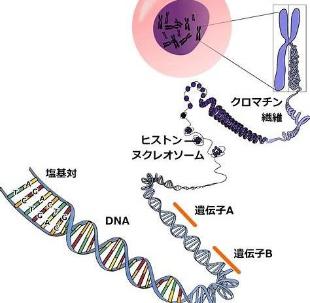
図2. DNAの塩基と遺伝子の関係性
(Pizabay, retrieved from: https://pixabay.com/ja/images/search/%E9%81%BA%E4%BC%9D%E5%AD%90/ )
前述したように、ヒトDNAの全塩基配列が解明され、さまざまな事がわかりました。例えば、ヒトDNAとチンパンジーDNAの違いは約1パーセントであることがわかりました。それでは、人類はみな共通の塩基配列をしたDNAを持っているのでしょうか。それは違います。ヒト同士でも0.1パーセント前後で違いがあります。それにより、肌の色、髪の毛の違い、身長の違い等が生まれているのです。詳しく説明をします。ヒトDNAの塩基配列の中に、自由に変化しても問題のない場所があります。その場所では、「ヒトDNA塩基配列」として世界で共有されている教科書的な配列とは違う塩基をもっていても、病気の発症には関連しないとされており、その異なる塩基配列がいわゆる個性を形成するものになります。例えば、30億対あるDNAの2万番目の塩基対がほとんどの人が[T-A]なのに、あなただけが[C-G]を持っていることによって、細く長い中指という特徴があるかもしれないのです。そのような、変化してもいい場所で「教科書的配列」とは異なる塩基配列を有するパターンを一塩基多型(single nucleotide polymorphism、SNP)と呼びます。30億対の塩基配列のなかで約1000万カ所は別の塩基に置き換わることができる場所です。おかげでさまざまな人種や個人が存在できる素晴らしい世の中になっているこということです。そして、これらのヒトDNA塩基配列から得られるすべての情報を「ゲノム」と呼びます。つまり、「ゲノム医療」とは、こうしたDNAから得られた情報を元に行う治療のことを指しています。
1(2) 遺伝子異常とがん
DNAや遺伝子の研究が進み、がんはさまざまな遺伝子の異常が積み重なり発症するということが明らかにされました。先ほど述べたように、30億対のDNAの中でよく調べられているSNP領域(約1000万カ所)では、塩基が他と違っていてもがんにはなりません。細胞の増殖機能や運動機能に強く関連するとわかっている遺伝子領域の塩基配列に変化が起こったとき、細胞はがんに変身する準備をするのです。現在、がんにかかわるといわれている遺伝子(がん関連遺伝子)は、報告により数が異なりますが、数十から数百遺伝子といわれています。
私たちの細胞は、さまざまな遺伝子や環境に制御され、バランスをとって生きています。遺伝子に異常が起こり、その制御機能が破綻してきたときに、正常な細胞が正常な動きをしなくなり、がん化します。それでは、がん関連遺伝子に変異が起きると正常な細胞はすぐにがん細胞に変化するのでしょうか。それは違います。がん化のプロセスは、人間社会が白黒はっきりせずにグレーゾーンが存在したり、陰の黒幕がいるのと同様に、大変複雑です。人間が十人十色といわれるように、がん化のプロセスも十人十色であることがわかってきました。がん細胞はそれぞれのストーリーを持ち、変化していきます。どちらかというと放っておいても全く悪さをしない隠れがん細胞もいれば、いつがん細胞になってもおかしくないちょっと危ない状態の細胞や、一気にすごい速さで増殖していく悪性度の高いがん細胞などそれぞれなのです。その「がん化」を決める情報の中でかなり大きな役割を占めているのが、がん関連遺伝子です。以下でがん関連遺伝子とがん化についてみていきましょう。
1(3) がん関連遺伝子について
私たちの細胞は、必要なときに増殖し、休み、自己を死に向かわせます。私たちの体は約60兆個の細胞からなっており、毎日約3000億個の細胞が死に、新しく細胞が生まれています。そのバランスをとることで、生体の秩序が保たれています。では、細胞はどのような時に死ぬのでしょうか。一つは熱や圧迫や化学物質などで細胞が物理的に壊されるとき、もう一つはプログラム細胞死といわれ、私たちのDNA の中に自殺遺伝子 が組み込まれており、死ぬべき時期が来ると自己的に死んでいきます。例えばウィルス感染した細胞は、他に感染を拡げないように自殺遺伝子を起動させて死んでいきます。しかし、細胞が死んでいくと同時に不足した部分を補うために新たな細胞が生まれ、組織すなわち人体が保たれています。このように、人体は必要に応じて細胞を減らしたり増やしたりして恒常性を維持しています。実は、その恒常性のメカニズムをつかさどっているのが、がん関連遺伝子なのです。
がん関連遺伝子は、がん遺伝子とがん抑制遺伝子に大別され研究が進められてきました。がん遺伝子は、細胞増殖という車のアクセルに相当する機能を有しており、遺伝子異常(変異)が起こると暴走、つまり細胞の異常増殖につながります。一方、がん抑制遺伝子は、細胞増殖を抑え、時に細胞死を誘導する役割を担い、車のブレーキに相当する機能を有します。よって、がん抑制遺伝子の異常でブレーキ機能がなくなると、異常増殖を止められなくなってしまいます。 がん遺伝子に異常が起きても、すぐに細胞ががん細胞に変化するわけではありません。実は、日々の生活の中で、がん遺伝子にたまたま変異が起こり、正常な細胞ががん化することは珍しいことではありません。そこでは通常、がん抑制遺伝子がその異変に気づき、アポトーシス機能や免疫機能を使って、がん細胞の増殖を食い止めているのです。しかし、がん遺伝子とがん抑制遺伝子の異常が同時に起こると、細胞が異常増殖してもそれを食い止めることができなくなり、異常増殖した細胞が正常な組織を破壊するようになる、これが「がん」という病態なのです。がん化に至る遺伝子異常は上述のようながん遺伝子、がん抑制遺伝子の異常だけではなく、ウイルスや細菌感染による遺伝子異常(HPV、ピロリ菌など)、DNAの修復を担う遺伝子の異常による発がんや、環境異常(DNAメチル化等)による発がん等、新たな機序が次々に解明され、その解釈は複雑になってきています。
1(4) がん関連遺伝子の異常と遺伝病
この章では、遺伝子病と遺伝病の違いについて理解を深めます。上述のように、がんはがん関連遺伝子の異常が重なることで発生する遺伝子病です。したがって、がんは「遺伝子病=遺伝子の異常で起こる病気」と解釈することは出来ますが、「遺伝子病=遺伝する病気」という解釈は間違っています。ただし、遺伝病としてのがんが存在するのも事実です。以下、その違いについて説明します。まず遺伝子病と遺伝病には明瞭 な違いがあります。一般的に「遺伝子病」としてがん関連遺伝子に異常が発生する場合、どのようなタイミングで異常が発症するでしょうか。それは、加齢や喫煙歴・放射線、あるいはウイルス感染などによる外因性要因が付加されたときで、それにより皮膚や粘膜などの体細胞のがん関連遺伝子に異常がおこるのです。この体細胞とは、卵子や精子の形成と関係がなく、遺伝することのない形質を持ちます。つまり、その癌細胞にしか存在しない性質を指します。こうした外因的要因による後天的な刺激で起こるがんは、全てのがんの約95パーセント程度を占めると報告されています。一方、「遺伝病」としてのがんは、生まれながらにがん抑制遺伝子に異常があることで発がんする場合を指します。生まれながらということは、受精卵の段階でがん抑制遺伝子に傷が入っていることを意味しており、それは全身の臓器を構成するすべての細胞のDNAにその遺伝子異常が存在します。そのため、遺伝病としてのがんの場合、複数の臓器でがんが発生しやすいといわれています。そのメカニズムをもう少し詳しく見てみましょう。1の(1)章で説明したように、ヒトの染色体は、父方(精子)、母方(卵子)から1本ずつ提供されるので2本ずつ存在します。つまり、同じ機能を有する遺伝子が2個存在しています。遺伝病としてのがんでは、生まれつきそのどちらか1本に異常があるのですが、もう片方の遺伝子が正常に機能している場合には発症しないので、中にはがんを発症せず寿命を全うする方も少なくありません。しかし、先に述べたような後天的な遺伝子の異常が追加され、片方の正常に機能していた遺伝子に異常が起こるとがん化につながります。つまり、遺伝病ではない方よりもがん化する確率が高く、そのタイミングも早くなる可能性があるのが遺伝病としてのがんなのです。従ってそのような方は、比較的若くしてがんを発症することや、がんを複数の臓器で発症する可能性が高くなります。家族に若年で発症したがんの方がたくさんがいる場合や、自身が若いときから複数のがんの診断を受けたことがある場合などは、遺伝病としてのがんの可能性を考え、遺伝カウンセリング外来の受診をお勧めしています。後述しますが、国が指定したがんゲノム医療中核拠点病院及び拠点病院には遺伝カウンセラーが常在しており、相談が可能です。
2.がんゲノム医療における遺伝子検査
2(1)検査の種類の理解
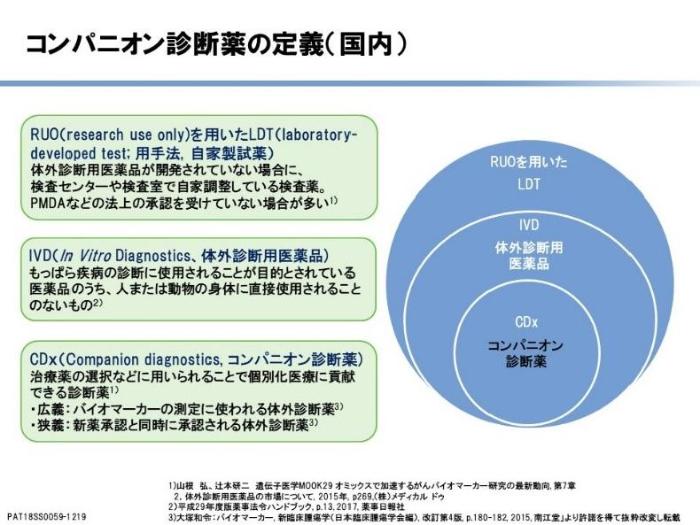
遺伝子検査を理解するために、まず日本における臨床検査の種類および検査体制を説明します。なお、臨床検査は試薬と機器を使った総合的な判断をするため、「検査」という言葉には検査薬と検査機器の両方の意味が含まれます。臨床検査薬は、用手法・自家製試薬(laboratory developed test ; LDT), 体外診断用医薬品(In Vitro Diagnostics ; IVD), コンパニオン診断薬(Companion diagnostics ; CDx)と呼ばれる3種類に大別されます。LDTは医療法により、「医師の指示の元に実地される院内検査」と規定されています。使用する検査薬の種類としては研究用試薬・研究用機器が含まれますが、こちらは薬事上の法的規制はないため、医師が自分の責任のもとで使用することになります。また検査の中には保険点数がついているものといないものがあり、多くは診断の補助に使われます。
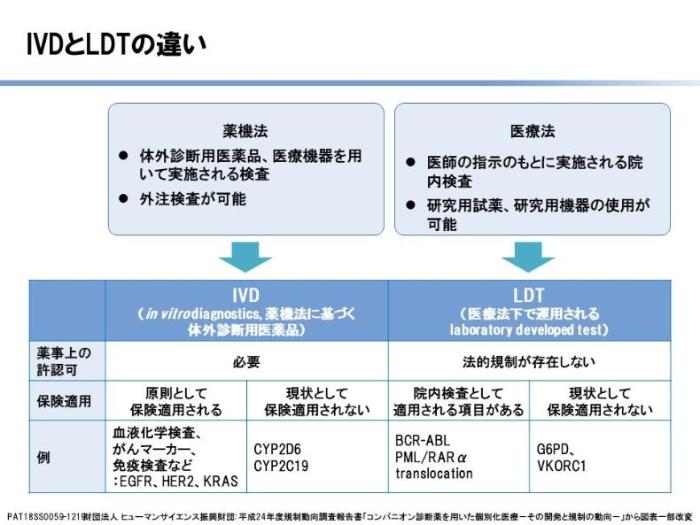
例えば、慢性骨髄性白血病の患者さんの95パーセント以上では、フィラデルフィア(Ph)染色体という異常な染色体が見つかっています。染色体異常はゲノム異常の一つです。慢性骨髄性白血病が発症する原因は、この染色体上にあるBCR-ABL遺伝子と同定されています。このBCR-ABL遺伝子を見つける検査は薬事承認を取得した検査が確立していないため、各病院がLDTとして検査方法を確立し、慢性骨髄性白血病と診断するLDT検査として実施しています。
次に、IVDについて説明します。こちらは薬機法に基づき体外診断用医薬品と定義されており、検査薬として薬事承認が必要になります。がん領域ではありませんが、インフルエンザ検査キットを例に説明します。Aさんは風邪症状がでたので病院にいきます。インフルエンザが流行している状況にあり、熱もあって関節痛があり、上気道症状があるので、医師は臨床的にインフルエンザ感染を疑いました。鼻の中に綿棒を挿入し鼻咽頭インフルエンザ抗原検査を行い、結果が陽性ならAまたはB型インフルエンザと診断されます。これが診断薬IVDです。Aさんに結果を説明後、抗インフルエンザ薬が処方されました。ではもし、同様な条件で検査をしたBさんが、同じ検査で陰性だった場合は、どうなるでしょうか。医師はBさんにも、抗インフルエンザ薬を投与しました。つまりIVDは診断に使われますが、投薬の可否を判断する検査ではありません。医師は検査が陰性でもインフルエンザの可能性が高いと判断し、薬を投薬することができます。
3つ目のCDxの説明に移りましょう。こちらは主にがん領域で行われる検査で、コンパニオン診断薬という名前ですが、飲む薬ではなく、ある特定の治療薬の有効性を判断するために行われる検査のことです。厚生労働省が、以下のように規定しています。「CDxは単に疾病の診断などを目的とするものを除く」つまり診断には用いてはいけません。具体的には、以下の目的で使用されるものとされています。
(1) 特定の薬の効果がより期待される患者を特定する。
(2) 特定の副作用が発現するおそれの高い患者を特定する。
(3) 用法・用量の最適化または投与中止の判断を適切に実施する。
CDxと薬は、基本的に一対一対応で存在しています。検査対象は特定のがん関連遺伝子異常がほとんどです。下表に保険償還されているCDxと対応薬、検査標的の一部を紹介します。
| コンパニオン検査名 | 検査項目 | 対応する医薬品 |
|---|---|---|
コバスBRAF V600 変異検出キット |
BRAF遺伝子 V600E変異 |
ゼルボラフ錠240mg(ベムラフェニブ) |
Vysis ALK Break Apart FISH プローブキット |
ALK融合遺伝子 | ザーコリカプセル200mg、同カプセル250mg(クリゾチニブ)、アレセンサカプセル150mg(アレクチニブ塩酸塩) |
| コバス EGFR 変異検出キット v2.0 | EGFR遺伝子変異 | イレッサ錠250(ゲフィチニブ)、タルセバ錠25mg、同錠100mg、同錠150mg(エルロチニブ塩酸塩)、ジオトリフ錠20mg、同錠30mg、同錠40mg、同錠50mg(アファチニブマレイン酸塩)、タグリッソ錠40mg、同錠80mg(オシメルチニブメシル酸塩)、ビジンプロ錠15mg、同錠45mg(ダコミチニブ水和物) |
| BRACAnalysis診断システム | BRCA1/2遺伝子変異 | リムパーザ錠100mg、同錠150mg(オラパリブ) |
OncoGuide AmoyDx ROS1 融合遺伝子検出キット |
ROS1融合遺伝子 | ザーコリカプセル200mg、同カプセル250mg(クリゾチニブ) |
| MEBGEN RASKET-B キット | KRAS/NRAS遺伝子変異 | アービタックス注射液100mg(セツキシマブ(遺伝子組換え))、ベクティビックス点滴静注100mg、同点滴静注400mg(パニツムマブ(遺伝子組換え)) |
2(2)がん遺伝子検査の歴史
2015年に、がん関連遺伝子を臨床検査として検索する「がん遺伝子パネル検査」(パネルというのはいくつかのがん関連遺伝子を組み合わせて検査するシステムを指します)が初めて開始されました。「OncoPrime」という外注型の海外の検査で、京都大学が導入しました。続いて2016年には北海道大学で院内完結型の遺伝子パネル検査「CLHURC検査」が始まりました(後に慶應大学で実施されている「PleSSision検査」に移行)。「OncoPrime」,「PleSSision検査」はいずれも自費検査であり、日本ではその結果に基づいて治療に用いる薬物を選択することは難しい状況でした。その後、東京大学の「TOP-panel」や大阪大学の「Oncomine」などさまざまな自費検査や先進医療としての遺伝子パネル検査が始まり、検査データが集積され、知見が集められていきました。そして2019年6月、ついにがん遺伝子パネル検査として「Foundation One CDxがんゲノムプロファイル(F-One)」、「OncoGuide NCCオンコパネルシステム(NCCOP)」の2種類の検査が保険償還されました。また、近年、Gardant 360などに代表される血中に浮遊するがん由来のDNAを検索するリキッドバイオプシーによる遺伝子パネル検査が自費診療で使われており、2021年3月には「Foudation One liquid CDx」という検査が薬機法承認される予定です(2021年2月現在)。従来の遺伝子パネル検査は組織を採取する必要がありましたが、リキッドバイオプシーは採血だけで検査を行うことができるという利点があり、膵臓がん等がん組織を直接取るのが難しいがん患者さんに対するがんゲノム医療の推進に期待が高まっています。
2(3)保険診療におけるがん遺伝子パネル検査
2017年「がんゲノム医療推進コンソーシアム懇談会」が実施され、日本におけるがんゲノム医療実装の枠組みが構築されました。まず遺伝子検査の精度確保に取り組むため、医療法等の一部が改正されました(平成29年法律第57号)。がんゲノム医療を提供しうる医療機関として、2018年2月にがんゲノム医療中核拠点病院や連携病院の指定が行われ、2020年4月、がんゲノム医療中核拠点病院は12カ所、拠点病院が33カ所、連携病院が161カ所指定されています(図3)。また、2018年6月にはがんゲノム医療情報の集約・管理・利活用推進機関として、がんゲノム情報管理センター(C-CAT)が設置されデータが集積されています。
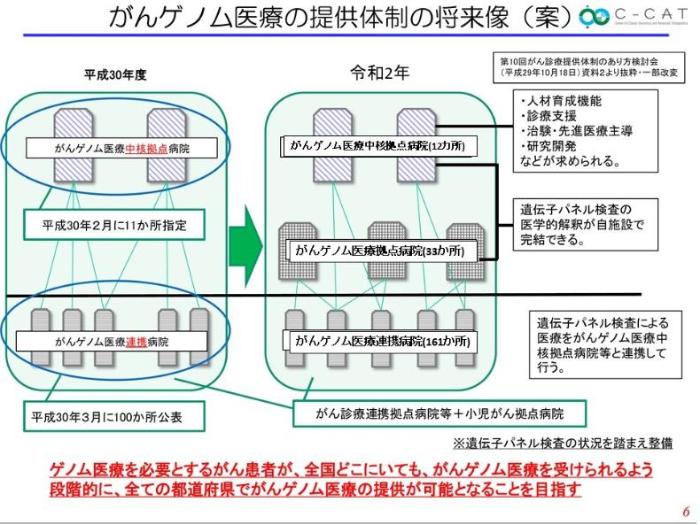
出典:第3回がんゲノム医療推進コンソーシアム運営会議の資料より抜粋し追記
次に、保険償還された2つのがん遺伝子パネル検査の内容の違いについて説明します。F-OneとNCCOPの最も大きな違いは、がん細胞のがん関連遺伝子の変化だけをみるのか、同時にがんではない細胞、すなわち正常細胞のがん関連遺伝子の変化も検索するのかという点です。がん細胞と正常細胞(一般的には血液中の白血球のDNAを検査します)の両方のがん関連遺伝子を検査するNCCOPに対し、F-One ではがん細胞の遺伝子のみを解析するということです。正常細胞の検査は、持って生まれた遺伝子異常を検出することにつながるため、1の(4)章で記載した「遺伝病」としてのがんの発見につながります。 NCCOPでは解析対象遺伝子数は114個の遺伝子変異(2021年5月からは124遺伝子に増える予定)と12個の融合遺伝子、F-Oneは324個の遺伝子(309個の遺伝子変異と36個の融合遺伝子)が検索対象となっています。
2(4)保険診療におけるがん遺伝子パネル検査を受けられる人
それでは、がんになった人は全員、即座に検査が受けられるのでしょうか。残念ながら、現状では、保険診療でがん遺伝子パネル検査を受けるには以下のどちらかの条件を満たし、かつ検査施行後に化学療法が可能な全身状態と判断された患者さんのみが対象となっています。
1)標準治療のない固形がん(希少がんや原発不明がん)
2) 標準治療終了又は終了見込みの固形がん患者
1)は原発が判らず、治療法を決められない原発不明癌や、人口10万人あたり6例未満と定義される希少がんのように、治療ガイドラインが作成されておらず、標準的な治療方法が確立されていない種類のがんを意味し、例えば骨軟部肉腫や悪性脳腫瘍などが挙げられます。これらの方は、診断の当初から検査を受けることができます。一方、2)は標準治療が存在するがんを有している患者さん、つまり一般的な大腸がんや乳がん、肺がんなどを意味します。こうした一般的ながんに対しては保険診療で実施可能なさまざまな標準治療が決められており、それらの治療が全て終了しているか、最後の治療に入った患者さんという意味です。つまり、がんの種類や個々の患者さんの病態にもよりますが、おおむね診断時からそれなりの時間が経た段階で検査を受けることになります。
この条件を患者さん御本人が的確に判断することは難しく、主治医や専門医が判断します。現実的には、上の条件を満たす患者さんは日本の全がん患者さんの2~3パーセント(約2~3万人)程度であり、大部分のがん患者さんは、まだ遺伝子パネル検査を受検することができない状況です。また、申し込みは2の(2)章で記載したがんゲノム医療中核拠点病院、拠点病院または全国の連携病院のみとなります。(厚生労働省 HP参照 https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/gan/gan_byoin.html )しかし、現状のがん遺伝子パネル検査の受診システムでは、検査の時期が遅れることで、治療に結び付くような遺伝子プロファイルが得られても、全身状態が悪くなり検査に至らないケースが少なくありません。これは、まだがん遺伝子パネル検査の精度が低く、コストが高いために受診者を制限せざるを得ないという背景があるためです。従って、がん遺伝子パネル検査をより多くのがん患者さんが少しでも早いタイミングで受診できるようになるためには、我々医療者が力を合わせて、より精度が高く低コストのがんゲノム検査を開発することが求められています。
2(5)検査結果の解釈、検査期間、検査結果の開示
がん遺伝子パネル検査は歴史が浅く、未成熟・不完成系の医療であるため、出てきた結果の解釈が難しい場合があります。従って、検査結果の評価、治療法の判断にはさまざまな視点から見ることが必要であり、厚労省は「エキスパートパネル」という専門家会議を行い、合議にて得られた検査結果を患者さんに説明するというルールを作成しました。エキスパートパネルに参加する医療従事者や専門家の構成要件は以下のように規定されています。
1)患者の主治医、もしくは主治医に代わる者
2)薬物療法に関する専門的な知識及び技能を有し、その分野での専門性が認知された領域の異なる複数名の常勤の医師
3)遺伝医学に関する専門的な知識を有する医師を1名以上
4)遺伝医学に関する専門的な遺伝カウンセリング技術を有する者を1名以上
5)もっぱら病理診断に携わる常勤の医師を複数名
6)分子遺伝学やがんゲノム医療に関する十分な知識を有する専門家を1名以上
検査自体は3-4週間で終了しますが、これらの専門家が事前にデータを検証したのちにエキスパートパネルが開かれるため、検査申し込みをしてから、外来での検査結果説明までは約1カ月半程度必要とされています。
3.がん遺伝子パネル検査とコンパニオン診断薬(CDx)との違い
CDxという検査のコンセプトは、がん個別化医療そのもの、と言うことが出来ます。何故なら、同じ診断名の腫瘍を有する患者さんに画一的な治療を行うのではなく、CDxの結果を用いて個々の患者さんごとに薬剤の投与を決めるからです。しかしCDxには問題点があります。それぞれの検査では一つの遺伝子変異しかとらえられないので、一つずつ順に検査を進めていく必要がありました。例えば、肺がんの患者さんが有効な薬をみつけるためにCDxをしていくとします。まずはEGFR遺伝子のCDxを行い、陰性であればALK遺伝子のCDxを行い、陰性であればROS遺伝子のCDxを行うという流れになるため、時間もかかり検体の消費も大きく、全てのCDxが実施できない場合も少なくありません。またCDxは検査対象のがん種(肺がんや胃がんなど)が決められており、決められたがん種以外のがんの方は基本的に検査がうけられません。ただ、2020年には初めて、臓器横断的に実施可能なMSI検査というコンパニオン検査が保険償還され、臓器横断的なコンパニオン検査も登場しています。
一方、遺伝子パネル検査は一度に数十~数百遺伝子を調べる検査なので、様々なCDxで検索している遺伝子を含めて一度に検索することが出来ます。その中には、CDxとして認められていないが特定の治療薬の有効性に関わるがん遺伝子も含まれており、治療選択の可能性が広がります。その代表が保険償還されているFoundationOne CDxです。検査名にCDxと書かれている通り、コンパニオン診断薬としても承認を受けており、その検査対象と薬剤は以下のようになっており、検査対象と薬剤がCDxと重なっていることがわかると思います。
| コンパニオン検査名 | 検査項目(癌種) | 対応する医薬品 |
|---|---|---|
| FoundationOne CDx | EGFR エクソン19欠失変異 及びEGFR p.L858R変異 (肺がん) |
イレッサ錠250(ゲフィチニブ)タルセバ錠25mg、同錠100mg、同錠150mg(エルロチニブ塩酸塩)、ジオトリフ錠20mg、同錠30mg、同錠40mg、同錠50mg(アファチニブマレイン酸塩)、タグリッソ錠40mg、同錠80mg(オシメルチニブメシル酸塩) |
| EGFR p.T790M変異 (肺がん) |
タグリッソ錠40mg、同錠80mg(オシメルチニブメシル酸塩) | |
| ALK融合遺伝子 (肺がん) |
ザーコリカプセル200mg、同カプセル250mg(クリゾチニブ)ジカディアカプセル150mg、同錠150mg(セリチニブ)アレセンサカプセル150mg(アレクチニブ塩酸塩) | |
| BRAF遺伝子 p.V600E変異及び p.V600K変異 (肺がん) |
タフィンラーカプセル50mg、同カプセル75mg(ダブラフェニブメシル酸塩)及びメキニスト錠0.5mg、同錠2mg(トラメチニブジメチルスルホキシド付加物)、ゼルボラフ錠240mg(ベムラフェニブ) | |
| ERBB2コピー数異常(HER2遺伝子増幅陽性) (乳がん) |
ハーセプチン注射用60、同注射用150(トラスツズマブ(遺伝子組換え))、KRAS/NRAS遺伝子変異 | |
| KRAS/NRAS遺伝子変異 (大腸がん) |
アービタックス注射液100mg(セツキシマブ(遺伝子組換え))、ベクティビックス点滴静注100mg、同点滴静注400mg(パニツムマブ(遺伝子組換え)) | |
| NTRK1/2/3 融合遺伝子 (肺がん) |
ロズリートレクカプセル100mg、同カプセル200mg(エヌトレクチニブ) | |
| BRCA1/2 遺伝子変異 (前立腺がん) |
リムパーザ錠100mg、同錠150mg(オラパリブ) |
FoundationOne CDxは、遺伝子パネル検査として2の(3)章で記載したタイミングで検査を受ける以外に、こうしたコンパニオン診断薬として特定の臓器のがんに対するコンパニオン診断薬として検査を行うことが出来ます。しかし、検査費用の問題、エキスパートパネルの必要性など、様々な運用上の問題点があるため、CDxとしての検査は実施されていないのが現状です。従って、遺伝子パネル検査として実施されたときに上記のCDx相当の結果が得られた時に治療薬を推奨する、という運用になっているために、本来検査を行うべきがん患者さんに適切な検査を提供できていないという大きな問題が存在しています。
一方、CDxとしての性格が優勢ながん遺伝子パネル検査もあります。2019年に非小細胞肺がんに対して承認されたオンコマインDx Target Testは、 BRAF, EGFR, ALK, ROS1の4つの遺伝子に対するマルチコンパニオン検査として承認されていますが、実態は46のがん関連遺伝子を同時に解析する遺伝子パネル検査です。従って上記4つの遺伝子変異結果を検出し報告すると同時に、他42種のがん関連遺伝子の情報も主治医の依頼に基づき参考データとして開示することが可能となっています。がん種は絞られてはいますが、検索範囲を拡げたコンパニオン検査であり、がん遺伝子パネル検査との中間的存在です。
ただ、個別に実施するCDxと遺伝子パネル検査タイプのCDxは検査方法が異なるため、CDxでは検出されても、遺伝子パネル検査では検出感度以下になり、変異を捉えられない事象があることも事実なので慎重な解釈が必要です。
4.がんゲノム医療の治療における問題と課題
今までは、各臓器別のがんの診断に分けて薬が開発され、大規模な治験によって有効性が評価されてきました。しかし、同じ診断名でも、がん細胞が持っている遺伝子変異は「十人十色」なので、個々のがん関連遺伝子の変異を対象に、薬を開発し治験を行う必要がでてきました。また、がん免疫学が急速に発展し、特定の患者さんに高い奏効率を示す免疫チェックポイント阻害剤も開発されて、様々ながん種で保険適用になっています。詳細は割愛しますが、がん免疫治療もがんの遺伝子変異と強い結びつきがあり、免疫チェックポイント阻害剤を対象にしたコンパニオン診断薬の1つがゲノム検査であるMSI検査です。
これまで述べてきたように、がんゲノム医療の検査体制の整備は徐々に進んできましたが、ゲノム異常に基づく治療体制はまだまだ不十分な段階にあります。遺伝子パネル検査で臓器横断的に変異を検出し、それに有効な承認薬が推奨されても、日本ではその薬剤が承認されている臓器が異なると適応外使用となるため保険診療内で薬を投与できず、治験や先進医療がなければ自費診療にて投薬するしかありません。自費診療では多額の治療費がかかるため、そのような治療を実施できる患者さんは一部に限られます。2020年から国立がん研究センターが中心となり、患者申出療養制度を活用した、適応外使用の体制構築が始まりました。しかし、この制度を利用するためには様々な制約が多く、その恩恵を受けられる患者さんはやはり限られています。
しかし、がんゲノム医療への希望の光は決して消えてはいません。検査制度、検査体制を整え、病態がより明確に整理され、個々の薬物治療に対する臨床データが集積されていくことで、新規の医薬品開発も進むと思われます。がんゲノム医療は確実に次の段階に上がり、革新的なスピードでの進歩が期待されます。そのために、早急に産官学が一体となった体制を構築することが求められています。
【終わりに】
多くの方にご理解いただけるよう専門用語や難しい表現を避けて説明してきたつもりですが、ご理解いただけたら幸いです。
医学は日進月歩、めまぐるしい速さで進歩しています。がんと向き合っている専門家は、少しでも長く患者さんに充実した日々を過ごしていただけるよう必死に研究を重ねています。近い将来、もっともっと正確な検査や有効な治療薬、治療法が生まれてくることは間違いありません。しかし一方で、ゲノムやがん免疫に名を借りた悪質な診療も後を絶ちません。情報化社会といわれるなか、あやしい情報に惑わされずに正しい情報を選ぶことが大切です。それが命と健康につながる医療情報、がん情報であればなおさらのこと、その重要性は今後ますます大きくなっていくことでしょう。
お問い合わせ
このページの担当は 医療政策部 医療政策課 がん対策担当(03-5320-4389) です。